PEMANFAATAN LIMBAH CAIR TAHU MENJADI BIOGAS
SEBAGAI BAHAN BAKAR ALTERNATIF
Anis Maryati , Umi Octaviana, Widya Nur Anggraini
Jurusan D-III Keperawatan STIKes Kusuma Husada Surakarta
E-mail : maryatianis95@yahoo.co.id
SEBAGAI BAHAN BAKAR ALTERNATIF
Anis Maryati , Umi Octaviana, Widya Nur Anggraini
Jurusan D-III Keperawatan STIKes Kusuma Husada Surakarta
E-mail : maryatianis95@yahoo.co.id
PENDAHULUAN
Pemanasan global yang diakibatkan kerusakan lingkungan beberapa
akhir ini menjadi topik yang hangat dibicarakan. Lapisan ozon
yang mulai menipis akibat efek rumah kaca, yang juga menjadikan
temperatur di bumi meningkat. Salah satu penyebab kerusakan lingkungan,
yaitu penggunaan energi dari fosil yang tidak ramah
lingkungan, seperti penggunaan solar dan bensin. Pengelolaan limbah
industri yang tidak memenuhi standar kesehatan lingkungan juga
menjadi salah satu penyebab rusaknya lingkungan. Untuk mengurangi
kerusakan lingkungan akibat penggunaan bahan bakar fosil ini, maka
perlu dicarikan energi alternatif yang ramah lingkungan.
Salah satu contoh
energi alternatif yang ramah lingkungan adalah penggunaan biogas.
Biogas adalah gas yang dihasilkan dari limbah rumah tangga, kotoran
hewan, kotoran manusia, sampah organik dan sebagainya, yang mengalami
proses penguraian atau fermentasi oleh mikroorganisme. Di samping
itu, adanya kenaikan tarif listrik, kenaikan harga LPG (Liquefied Petroleum
Gas), premium, minyak tanah dan bahan bakar lainnya, menjadikanbiogas
sebagai sumber energi yang ramah lingkungan dan murah. Salah satu
limbah yangberpotensi dijadikan sumber biogas yaitu limbah tahu. Hal ini
dilakukan karena melihat banyaknya industri-industri tahu di Indonesia yang
belum memanfaatkan limbahnya dengan baik dan ramaah lingkungan. Untuk itu perlu
diadakan penelitian lebih lanjut dalam memanfaatkan limbah tahu sebagai bahan
alternatif pembuatan biogas dengan judul “Pemanfaatan Limbah Cair Tahu Sebagai
Bahan Baku Alternatif Pembuatan Biogas”
Pada umumnya, biogas mengandung 50-80%
metana, CO2, H2S dan sedikit air, yang bisa dijadikan sebagai pengganti minyak
tanah atau LPG. Dengan mengkonversi limbah cair pabrik tahu menjadi biogas,
pemilik pabrik tahu tidak hanya berkontribusi dalam menjaga lingkungan tetapi
juga meningkatkan pendapatannya dengan mengurangi konsumsi bahan
bakar pada proses pembuatan tahu.
HASIL DAN PEMBAHASAN
Secara garis besar penguraian senyawa organik secara anaerob di bagi menjadi dua yakni penguraian satu tahap dan penguraian dua tahap (Said & Wahjono, 1999).
a. Penguraian satu tahap merupakan penguraian anaerobik membutuhkan tangki fermentasi yang besar, memiliki pencampur mekanik yang besar, pemanasan, pengumpul gas, penambahan lumpur, dan keluaran supernatan (Metcalf dan Eddy, 1991). Penguraian lumpur dan pengendapan terjadi secara simultan dalam tangki. Stratifikasi lumpur dan membentuk lapisan berikut dari bawah ke atas : lumpur hasil penguraian, lumpur pengurai aktif, lapisan supernatan (jernih), lapisan buih (skum), dan ruang gas.
b. Penguraian dua tahap merupakan proses yang membutuhkan dua tangki pengurai (reaktor) yakni satu tangki berfungsi mencampur secara terusmenerus dan pemanasan untuk stabilisasi lumpur, sedangkan tangki yang satu lagi untuk pemekatan dan penyimpanan sebelum dibuang ke pembuangan. Proses ini dapat menguraikan senyawa organik dalam jumlah yang lebih besar dan lebih cepat. Proses pengelolaan bahan organik menjadi biogas dengan proses anaerobik serta visualisasi sistem produksi dan pemanfaatan biogas adalah sebagai berikut.
Prinsip pembangkit biogas merupakan menciptakan alat yang kedap udara dengan bagian-bagian pokok terdiri atas pencerna (digester), lubang pemasukan bahan baku dan pengeluaran lumpur sisa hasil pencernaan (slurry), dan pipa penyaluran biogas yang terbentuk. Dalam sarana digester ini terdapat bakteri methan yang mengelola limbah cair tahu dan memakan bahan-bahan organik dan menghasilkan biogas. Gas yang terbentuk tersebut difasilitasi dengan adanya pipa yang didesain sedemikian rupa sehingga gas tersebut dapat dialirkan ke kompor yang terletak di dapur. Gas tersebut dapat digunakan untuk keperluan memasak dan lampu penerangan.
Gambar 1. Perakitan alat
Proses anaerob terdiri dari empat tahap yaitu: hidrolisis, pembentukan asam, pembentukan asetat dan pembentukan metana. Proses anaerob dikendalikan oleh empat golongan bakteri, yaitu hidrolitik, acidogenik, acetogenik, dan methanogenik. Bakteri hidrolitik terdapat dalam jumlah yang besar dalam kotoran unggas karena reproduksinya sangat cepat. Organisme ini memecah senyawa organik kompleks menjadi senyawa yang lebih sederhana. Senyawa sederhana diuraikan oleh bakteri penghasil asam (acid-forming bacteria) menjadi asam lemak, keton dan alkohol Asam lemak dan alkohol diuraikan oleh bakteri asetogenik menjadi asam asetat, hydrogen dan karbondioksida. Selanjutnya bakteri metanogenik akan mengubah asam-asam tersebut menjadi metana. Sejumlah bakteri anaerob fakultatif yang terlibat dalam proses hidrolisis dan fermentasi senyawa organik antara lain Bacteroides, Bifidobacterium, Clostridium, Lactobacillus, & Streptococcus dan bakteri acidogenik seperti Clostridium, bakteri acetogenik seperti Syntrobacter wolinii dan Syntrophomonas wolfei (Said, 2006). Bakteri metana yang telah berhasil diidentifikasi terdiri dari genus yaitu bakteri batang, tidak membentuk sporsa yaitu Metahnobacterium, bakteri bentuk batang dan membentuk spora yaitu Methanobacillus, bakteri bentuk kokus yaitu Methanococcus atau kelompok koki yang membagi diri, bakteri bentuk sarcina tumbuh dalam kotak yang terdiri dari 8 sel yaitu Methanosarcina.
PELUANG PENELITIAN LANJUT
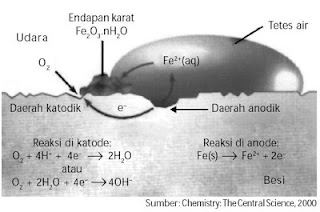
Terdapat dua jenis tangki penyimpanan gas, yaitu sumur pencerna bersatu dengan tangki pengumpul gas (floating dome) dan terpisah dengan pengumpul gas (fixed dome). Untuk tangki terpisah, konstruksi dibuat khusus sehingga tidak bocor dan tekanan yang terdapat dalam tangki seragam, serta dilengkapi H2S removal untuk mencegah korosi. pada tangki terpisah penulis penelitiannya belum berhasil dan masih melakukan treatment karena untuk memindahkan gas dari penampung awal ke penampungan akhir membutuhkan tekanan yang besar.
Terdapat dua jenis tangki penyimpanan gas, yaitu sumur pencerna bersatu dengan tangki pengumpul gas (floating dome) dan terpisah dengan pengumpul gas (fixed dome). Untuk tangki terpisah, konstruksi dibuat khusus sehingga tidak bocor dan tekanan yang terdapat dalam tangki seragam, serta dilengkapi H2S removal untuk mencegah korosi. pada tangki terpisah penulis penelitiannya belum berhasil dan masih melakukan treatment karena untuk memindahkan gas dari penampung awal ke penampungan akhir membutuhkan tekanan yang besar.