1. Definisi / Pengertian Korosi
Korosi atau Perkaratan berasal
dari bahasa latin ”Corrodere”
yang berarti perusakan logam. Adapun definisi korosi sebagai berikut.
– Korosi
adalah proses degradasi atau deteorisasi perusakan material yang terjadi
disebabkan oleh pengaruh lingkungan sekelilingnya.
– Korosi
adalah Kebalikan dari metalurgi ekstraktif.
– Korosi
adalah proses elektrokimia dalam mencapai kesetimbangan thermodinamika suatu
sistem.
– Korosi
adalah reaksi antara logam dengan lingkungannya.
Korosi adalah suatu penyakit dalam dunia teknik, walaupun secara
langsung bukan merupakan produk teknik. Adanya studi tentang korosi adalah
usaha untuk mencegah dan mengendalikan kerusakan supaya serangannya serendah
mungkin dan dapat melampaui nilai ekonomisnya, atau umur tahannya material
lebih lama untuk bisa dimanfaatkan. Caranya dengan usaha prefentif atau pencegahan dini untuk menghambat
korosi. Dan hal ini lebih baik dari pada harus mengeluarkan biaya perbaikan
yang tidak sedikit akibat serangan korosi.
Korosi pada logam terjadi akibat interaksi
antara logam dan lingkungan yang bersifat korosif, yaitu lingkungan yang lembap
(mengandung uap air) dan diinduksi oleh adanya gas O2, CO2, atau H2S. Korosi dapat
juga terjadi akibat suhu tinggi. Korosi pada logam dapat juga dipandang sebagai
proses pengembalian logam ke keadaan asalnya, yaitu bijih logam. Misalnya,
korosi pada besi menjadi besi oksida atau besi karbonat.
4Fe(s)
+ 3O2(g) + 2nH2O(l) → 2Fe2O3.nH2O(s)
Fe(s)
+ CO2(g) + H2O(l) → Fe2CO3(s)
+ H2(g)
Oleh
karena korosi dapat mengubah struktur dan sifat-sifat logam maka korosi
cenderung merugikan. Diperkirakan sekitar 20% logam rusak akibat terkorosi pada
setiap tahunnya.
Logam
yang terkorosi disebabkan karena logam tersebut mudah teroksidasi.
Menurut tabel
potensial reduksi standar,
selain logam emas umumnya logam-logam memiliki potensial reduksi standar lebih
rendah dari oksigen.
Jika
setengah reaksi
reduksi logam
dibalikkan (reaksi oksidasi logam) digabungkan dengan setengah reaksi reduksi
gas O2 maka akan dihasilkan nilai potensial sel, Esel positif.
Jadi, hampir semua logam dapat bereaksi dengan gas O2 secara spontan.
Beberapa
contoh logam yang dapat dioksidasi oleh oksigen ditunjukkan pada persamaan
reaksi berikut.
4Fe(s) + O2(g) + 2nH2O(l) → 2Fe2O3.nH2O(s) Esel = 0,95 V
Zn(s) + O2(g) + 2H2O(l) → Zn(OH)4(s) Esel = 0,60 V
2. Jenis-jenis
Korosi
Adapun
beberapa jenis korosi yang umum terjadi pada logam sebagai berikut.
1.
Korosi Galvanis (Bemetal Corrosion)
 Disebut
juga korosi dwilogam yang merupakan perkaratan elektrokimiawi apabila dua macam
metal yang berbeda potensial dihubungkan langsung di dalam elektrolit yang
sama. Elektron akan mengalir dari metal yang kurang mulia (anodik) menuju ke
metal yang lebih mulia (katodik). Akibatnya metal yang kurang mulia berubah
menjadi ion-ion positif karena kehilangan elektron. Ion-ion positif metal
bereaksi dengan ion-ion negatif yang berada di dalam elektrolit menjadi garam
metal. Karena peristiwa ini, permukaan anoda kehilangan metal sehingga
terrbentuk sumur-sumur karat atau jika merata akan terbentuk karat permukaan.
Disebut
juga korosi dwilogam yang merupakan perkaratan elektrokimiawi apabila dua macam
metal yang berbeda potensial dihubungkan langsung di dalam elektrolit yang
sama. Elektron akan mengalir dari metal yang kurang mulia (anodik) menuju ke
metal yang lebih mulia (katodik). Akibatnya metal yang kurang mulia berubah
menjadi ion-ion positif karena kehilangan elektron. Ion-ion positif metal
bereaksi dengan ion-ion negatif yang berada di dalam elektrolit menjadi garam
metal. Karena peristiwa ini, permukaan anoda kehilangan metal sehingga
terrbentuk sumur-sumur karat atau jika merata akan terbentuk karat permukaan.
2.
Korosi Sumuran (Pitting Corrosion)
Adalah
korosi yang terjadi karena komposisi logam yang tidak homogen dan ini
menyebabkan korosi yang dalam pada berbagai tempat. Dapat juga adanya kontak
antara logam, maka pada daerah batas akan timbul korosi berbentuk sumur.
Logam
yang sebelumnya teleh terkena erosi akibat terjadinya keausan dan menimbulkan
bagian-bagian yang tajam dan kasar. Bagian-bagian inilah yang mudah terserang
korosi dan apabila terdapat gesekan maka akan menimbulkan abrasi yang lebih
berat.
Gaya-gaya
seperti tarikan (tensile) atau kompresi (Compressive) berpengaruh
sangat kecil pada proses pengkaratan. Adanya kombinasi antara regangan tarik
(tensile stress) dan lingkungan yang korosif, maka akan terjadi kegagalan
material berupa retakan yang disebut retak karat regangan.
Korosi
yang terjadi pada logam yang berdempetan dengan logam lain atau non logam dan
diantaranya terdapat celah yang dapat menahan kotoran dan air sebagai sumber
terjadinya korosi. Konsentrasi Oksigen pada mulut lebih kaya dibandingkan pada
bagian dalam, sehingga bagian dalam lebih anodik dan bagian mulut menjadi
katodik. Maka terjadi aliran arus dari dalam menuju mulut logam yang
menimbulkan korosi.
Atau
juga perbedaan konsenrasi zat asam. Diamana celah sempit yang terisi elektrolit
(pH rendah) maka terjadilah sel korosi dengan katodanya permukaan sebelah luar
celah yang basah dengan air yang lebih banyak mengandung zat asam dari pada
daerah dalam yang besifat anodik. Maka dari snilah terjadinya korosi dengan
adanya katoda dan anoda.
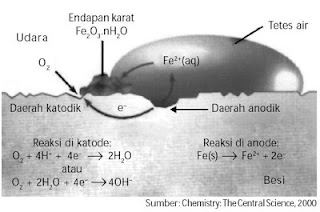
3. Mekanisme / Proses Terjadinya Korosi pada Besi
Oleh karena besi merupakan bahan utama untuk berbagai konstruksi
maka pengendalian korosi menjadi sangat penting. Untuk dapat mengendalikan
korosi tentu harus memahami bagaimana mekanisme korosi pada besi. Korosi
tergolong proses elektrokimia, seperti yang ditunjukkan pada Gambar 1.
Besi memiliki permukaan tidak halus akibat komposisi yang tidak
sempurna, juga akibat perbedaan tegangan permukaan yang menimbulkan potensial
pada daerah tertentu lebih tinggi dari daerah lainnya. Pada daerah anodik
(daerah permukaan yang bersentuhan dengan air) terjadi pelarutan atom-atom besi
disertai pelepasan elektron membentuk ion Fe2+ yang larut dalam air.
Fe(s) → Fe2+(aq) + 2e–
Elektron yang dilepaskan mengalir melalui besi, sebagaimana
elektron mengalir melalui rangkaian luar pada sel volta menuju daerah katodik
hingga terjadi reduksi gas oksigen dari udara:
O2(g) + 2H2O(g) + 2e– →
4OH–(aq)
Ion Fe2+ yang larut dalam tetesan air bergerak menuju daerah
katodik, sebagaimana ion-ion melewati jembatan garam dalam sel
volta dan
bereaksi dengan ion-ion OH– membentuk Fe(OH)2. Fe(OH)2 yang
terbentuk dioksidasi oleh oksigen membentuk karat.
Fe2+(aq) + 4OH–(aq) → Fe(OH)2(s)
2Fe(OH)2(s) + O2(g) → Fe2O3.nH2O(s)
Reaksi keseluruhan pada korosi besi adalah sebagai berikut
(lihat mekanisme pada Gambar 2) :
4Fe(s) + 3O2(g) + n H2O(l) → 2Fe2O3.nH2O(s)
Karat
Akibat adanya migrasi ion dan elektron, karat sering terbentuk
pada daerah yang agak jauh dari permukaan besi yang terkorosi (lubang). Warna
pada karat beragam mulai dari warna kuning hingga cokelat merah bahkan sampai
berwarna hitam. Warna ini bergantung pada jumlah molekul H2O yang terikat pada karat.
Emas dengan potensial reduksi standar 1,5 V lebih besar
dibandingkan potensial reduksi standar gas O2 (1,23 V) sehingga emas tidak terkorosi
di udara terbuka. Di alam emas terdapat sebagai logam murni.
4. Faktor-Faktor yang Mempengaruhi / Penyebab Korosi
Korosi dapat terjadi jika ada udara (khususnya gas O2) dan air. Jika hanya ada air atau gas O2 saja, korosi tidak terjadi. Adanya garam
terlarut dalam air akan mempercepat proses korosi. Hal ini disebabkan dalam
larutan garam terdapat ion-ion yang membantu mempercepat hantaran ion-ion Fe2+ hasil oksidasi.
Kekerasan karat meningkat dengan cepat oleh adanya garam sebab
kelarutan garam meningkatkan daya hantar ion-ion oleh larutan sehingga
mempercepat proses korosi. Ion-ion klorida juga membentuk senyawa kompleks yang
stabil dengan ion Fe3+. Faktor ini cenderung meningkatkan kelarutan besi sehingga
dapat mempercepat korosi.
5. Pengendalian / Cara Pencegahan Korosi
Korosi logam tidak dapat dicegah, tetapi dapat dikendalikan
seminimal mungkin. Ada tiga metode umum untuk mengendalikan korosi, yaitu
pelapisan (coating), proteksi katodik, dan penambahan zat inhibitor korosi.
a. Metode Pelapisan (Coating)
Metode pelapisan adalah suatu upaya mengendalikan korosi dengan
menerapkan suatu lapisan pada permukaan logam besi. Misalnya, dengan pengecatan
atau penyepuhan logam. Penyepuhan besi biasanya menggunakan logam krom atau
timah. Kedua logam ini dapat membentuk lapisan oksida yang tahan terhadap karat
(pasivasi) sehingga besi terlindung dari korosi. Pasivasi adalah pembentukan
lapisan film permukaan dari oksida logam hasil oksidasi yang tahan terhadap
korosi sehingga dapat mencegah korosi lebih lanjut.
Logam seng juga digunakan untuk melapisi besi (galvanisir),
tetapi seng tidak membentuk lapisan oksida seperti pada krom atau timah,
melainkan berkorban demi besi. Seng adalah logam yang lebih reaktif dari besi,
seperti dapat dilihat dari potensial setengah reaksi oksidasinya:
Zn(s) → Zn2+(aq) + 2e– Eo = –0,44 V
Fe(s) → Fe2+(g) + 2e– Eo = –0,76 V
Fe(s) → Fe2+(g) + 2e– Eo = –0,76 V
Oleh karena itu, seng akan terkorosi terlebih dahulu daripada besi. Jika pelapis seng habis maka besi akan terkorosi bahkan lebih cepat dari keadaan normal (tanpa seng). Paduan logam juga merupakan metode untuk mengendalikan korosi. Baja stainless steel terdiri atas baja karbon yang mengandung sejumlah kecil krom dan nikel. Kedua logam tersebut membentuk lapisan oksida yang mengubah potensial reduksi baja menyerupai sifat logam mulia sehingga tidak terkorosi.
b. Proteksi Katodik
Proteksi katodik adalah metode yang sering diterapkan untuk
mengendalikan korosi besi yang dipendam dalam tanah, seperti pipa ledeng, pipa
pertamina, dan tanki penyimpan BBM. Logam reaktif seperti magnesium dihubungkan
dengan pipa besi. Oleh karena logam Mg merupakan reduktor yang lebih reaktif
dari besi, Mg akan teroksidasi terlebih dahulu. Jika semua logam Mg sudah
menjadi oksida maka besi akan terkorosi. Proteksi katodik ditunjukkan pada
Gambar 3.
Reaksi yang terjadi dapat ditulis sebagai berikut.
Anode : 2Mg(s) → 2Mg2+(aq) + 4e–
Katode : O2(g) + 2H2O(l) + 4e– → 4OH–(aq)
Reaksi : 2Mg(s) + O2(g) + 2H2O → 2Mg(OH)2(s)
Katode : O2(g) + 2H2O(l) + 4e– → 4OH–(aq)
Reaksi : 2Mg(s) + O2(g) + 2H2O → 2Mg(OH)2(s)
Oleh sebab itu, logam magnesium harus selalu diganti dengan yang baru dan selalu diperiksa agar jangan sampai habis karena berubah menjadi hidroksidanya.
c. Penambahan Inhibitor
Inhibitor adalah zat kimia yang ditambahkan ke dalam suatu
lingkungan korosif dengan kadar sangat kecil (ukuran ppm) guna mengendalikan
korosi. Inhibitor korosi dapat dikelompokkan berdasarkan mekanisme
pengendaliannya, yaitu inhibitor anodik, inhibitor katodik, inhibitor campuran,
dan inhibitor teradsorpsi.
1) Inhibitor anodik
Inhibitor anodik adalah senyawa kimia yang mengendalikan korosi
dengan cara menghambat transfer ion-ion logam ke dalam air. Contoh inhibitor
anodik yang banyak digunakan adalah senyawa kromat dan senyawa molibdat.
2) Inhibitor katodik
Inhibitor katodik adalah senyawa kimia yang mengendalikan korosi
dengan cara menghambat salah satu tahap dari proses katodik, misalnya
penangkapan gas oksigen (oxygen scavenger) atau pengikatan ion-ion hidrogen.
Contoh inhibitor katodik adalah hidrazin, tannin, dan garam sulfit.
3) Inhibitor campuran
Inhibitor campuran mengendalikan korosi dengan cara menghambat
proses di katodik dan anodik secara bersamaan. Pada umumnya inhibitor komersial
berfungsi ganda, yaitu sebagai inhibitor katodik dan anodik. Contoh inhibitor
jenis ini adalah senyawa silikat, molibdat, dan fosfat.
4) Inhibitor teradsorpsi
Inhibitor teradsorpsi umumnya senyawa organik yang dapat
mengisolasi permukaan logam dari lingkungan korosif dengan cara membentuk film
tipis yang teradsorpsi pada permukaan logam. Contoh jenis inhibitor ini adalah
merkaptobenzotiazol dan 1,3,5,7–tetraaza–adamantane.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Mudah dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.













0 komentar:
Posting Komentar